Serce: nasz najważniejszy organ
Każdego roku około 7 milionów ludzi na świecie ma zawał serca, a choroby serca są najczęstszą przyczyną śmierci w Europie. Poważny zawał serca pozostawia po sobie zniszczenia, których ciało nie jest w stanie całkowicie naprawić. Dlaczego ludzkie serce nie może wyleczyć się samo, skoro inne części naszego ciała, przykładowo skóra czy krew, są ciągle odnawiane i naprawiane? Czy badania nad komórkami macierzystymi dostarczą nam nowych możliwości, aby naprawić uszkodzone serce?
Po zniszczeniach dokonanych w czasie zawał serce nigdy nie zostaje w pełni odbudowane.
Wbrew temu, co wcześniej sądzono, badania wykazują, że komórki mięśnia sercowego (kardiomiocyty) tworzą się i powoli zastępują zużyte komórki przez całe nasze życie. Im jesteśmy starsi, tym proces ten jest powolniejszy; jest on zbyt powolny, aby naprawić zniszczenia dokonane w czasie zawału mięśnia sercowego.
Naukowcy są w stanie wytworzyć kardiomiocyty i komórki rozrusznika w laboratorium wykorzystując embrionalne komórki macierzyste i indukowane pluripotencjalne komórki macierzyste (komórki iPS). Chociaż naukowcy mają nadzieję, że komórki macierzyste mogą być w przyszłości stosowane do naprawy zniszczonego serca, obecnie nie istnieją sprawdzone sposoby leczenia z wykorzystaniem komórek macierzystych.
Nie wiadomo, w jaki sposób tworzą się nowe kardiomiocyty. Niektórzy naukowcy sugerują, że istnieją komórki macierzyste serca, jednak aby to potwierdzić, potrzeba więcej danych.
Naukowcy są zainteresowani regeneracją serc innych zwierząt. Wiedza ta może doprowadzić do odkrycia, w jaki sposób wspomóc zdolność regeneracji serca ludzkiego.
Obecnie prowadzone są również badania nad sposobami stymulacji komórek serca do mnożenia się i naturalnej naprawy zniszczeń.
Naukowcy pracują również nad stworzeniem w laboratorium jednorodnych, przewidywalnych i bezpiecznych kardiomiocytów do wykorzystania w przeszczepach.
Leczenie serca niesie ze sobą znaczne ryzyko, ponieważ jest to organ kluczowy dla utrzymania życia.
Stosowanie do przeszczepów pluripotencjalnych komórek macierzystych, takich jak komórki iPS, wymaga potwierdzenia, że wszystkie komórki są naprawdę kardiomiocytami. Przypadkowe przeszczepienie komórek pluripotencjalnych niesie ze sobą ryzyko powstania nowotworów, wytworzenia niepożądanych typów komórek i wystąpienia innych komplikacji.
W przypadku prawidłowego wytworzenia kardiomiocytów do przeszczepu dodatkową komplikacją jest zapewnienie, aby rytm uderzeń tych komórek był taki sam jak w przypadku oryginalnych kardiomiocytów.
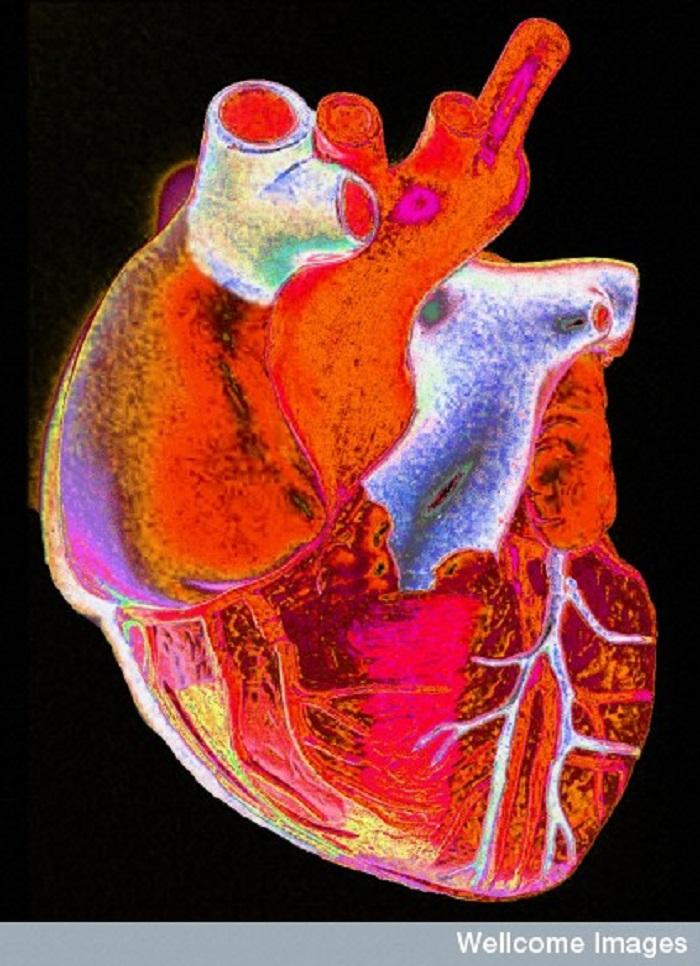
Serce jest pierwszym organem który jest formowany podczas rozwoju ciała. Kiedy embrion składa się zaledwie z kilku komórek, każda z komórek może otrzymać składniki odżywcze bezpośrednio z otoczenia. Podczas gdy komórki dzielą się i mnożą formując rosnącą kulę, szybko niemożliwe staje się efektywne zaopatrywanie wszystkich komórek w składniki odżywcze bez żadnej pomocy. Komórki produkują również odpady, których muszą się pozbyć. Tak więc krew i system cyrkulacji napędzany poprzez serce rozwijają się jako pierwsze. System ten potrzebny jest do przenoszenia składników odżywczych i odpadów w obrębie embrionu, aby zachować komórki przy życiu.
Podczas naszego życia serce kontynuuje swoją ważną rolę pompowania krwi w obrębie ciała. Jednak spora liczba pacjentów cierpi na choroby, które pogarszają zdolność serca do wykonywania swojej funkcji. Raz uszkodzone dorosłe ludzkie serce nie może ulec całkowitej naprawie. To poprowadziło naukowców do poszukiwania nowych dróg w celu zastąpienia uszkodzonych komórek w sercu. Naukowcy szukają alternatyw dla obecnie jedynej dostępnej terapii chorób serca – transplantacji serca.
Przez jakiś czas naukowcy wierzyli, że serce dorosłego w ogóle nie ma zdolności do tworzenia nowych komórek mięśnia sercowego (kardiomiocytów). Testy bomb nuklearnych zmieniły ten pogląd. Bomby nuklearne testowane były na powierzchni w latach 50-tych XX wieku aż do roku 1963. Eksplozje testowanych bomb wyemitowały do atmosfery radioaktywny typ węgla zwany C-14. Archeologowie używają tej metody od wielu lat do obliczania wieku żyjących niegdyś organizmów bazując na zawartości w nich węgla C-14. Biologowie używają obecnie tej samej techniki „datowania węglem” do określenia wieku kardiomiocytów w sercu żyjących osób. Odkryli, że średnio kardiomiocyty u dorosłej osoby są sześciokrotnie młodsze od danej osoby. Oznacza to, że nasze ciało musi tworzyć nowe kardiomiocyty.
Niestety produkcja nowych kardiomiocytów w naszym ciele spada wraz z wiekiem. W pierwszych dekadach naszego życia każdego roku około dwóch procent naszych kardiomiocytów jest zastępowanych nowymi komórkami, jednak gdy osiągniemy wiek około 70 lat tylko mała frakcja około jednego procenta komórek jest zastępowana. Innymi słowy, zdolność naszego serca do tworzenia nowych kardiomiocytów kiedy potrzebujemy ich najbardziej, na przykład kiedy mamy zawał serca, jest bardzo ograniczony.
Odkrycie, że serce dorosłego tworzy nowe kardiomiocyty, pomimo że w powolnym tempie, otworzyło nowy pole nauki i stworzyło nadzieję, że będzie możliwe aby uszkodzone serce pacjenta zaczęło produkować nowe komórki i naprawiało się samo. Naukowcy starają się dowiedzieć skąd pochodzą nowe kardiomiocyty i zrozumieć jak kontrolowana jest produkcja tych nowych komórek przez zdrowe ciało. Kilka grup badawczych sugeruje, że może to komórki macierzyste w sercu dorosłego człowieka tworzą nowe kardiomiocyty. Jednakże nie ma całkowitej zgodności pomiędzy naukowcami na temat pochodzenia sercowych komórek macierzystych, a ich istnienie nie zostało potwierdzone.
Na początku tego wieku naukowcy sugerowali, że komórki ze szpiku kostnego mogą pomóc w naprawie serca. Mysie komórki szpiku kostnego zostały przeszczepione do myszy, u których zaindukowano atak serca lub zawał mięśnia sercowego. Wyniki sugerowały, że komórki szpiku kostnego mogą tworzyć nowe komórki mięśnia sercowego zwane kardiomiocytami (z czasem udowodniono, że jednak nie jest to możliwe). Nie było zaskoczeniam, że to potencjalnie nowe rozwiązanie ogromnego problemu, jakim są choroby serca oznaczało, że te wczesne odkrycia zostały szybko wprowadzone do prób klinicznych na ludziach.
Rezultaty z tych badań klinicznych były niejednoznaczne: niektóre wyniki pokazywały nieznaczną poprawą wydolności serca pacjentów leczonych komórkami ze szpiku kostnego, podczas gdy inne wyniki nie wykazywały żadnej poprawy. Metody użyte do pomiaru prawidłowej pracy serca różniły się pomiędzy badaniami. Podczas gdy w niektórych badaniach używano najnowocześniejszych technik wizualizacji do określenia jak dużo krwi pompuje serce, inne używały starszych technik obrazowania opartych o radiologię. Te starsze radiologiczne techniki mogą czasem wskazywać wzrost pompowania krwi przez serce nawet, jeśli w rzeczywistości serce ‘sztywnieje’. Podsumowując, nawet najbardziej udane badania kliniczne nie wykazały poprawy wydolności serca w porównaniu z istniejącymi metodami leczenia.
Początkowe badania które sugerowały, że komórki z mysiego szpiku kostnego mogą przekształcić się w komórki mięśnia sercowego (kardiomiocyty) po transplantacji zostały uznane za błędne. Badania polegały na znalezieniu specyficznych genów umożliwiających zidentyfikowanie kardiomiocytów w sercu które, jak uważano, rozwinęły się z przeszczepionych komórek szpiku kostnego. Jednakże nowsze badania używające innego zestawu genów do zidentyfikowania kardiomiocytów dawały inne rezultaty. Obecnie powszechnie uznaje się, że komórki szpiku kostnego nie posiadają zdolności do przekształcenia się w kardiomiocyty po przeszczepieniu ich do serca. Komórki szpiku mogą natomiast łączyć się z istniejącymi już kardiomiocytami w sercu. Badania kliniczne, w których używa się komórek szpiku kostnego są mimo wszystko kontynuowane w nadziei, że te komórki te mogą mieć jakiś inny pozytywny wpływ na serce.
Kardiomiocyty mogą być wyhodowane w laboratorium z komórek macierzystych, które nie są spotykane w sercu:
1. Embrionalne komórki macierzyste mogą być stosunkowo łatwo używane do tworzenia kardiomiocytów w laboratorium, ale wiele przeszkód pozostaje do pokonania, zanim będą mogły być użyte u pacjentów.
2. Naukowcy tworzą kardiomiocyty także z indukowanych pluripotencjalnych komórek macierzystych (komórki iPS), to typ komórek macierzystych, który może być wytworzony w laboratorium poprzez przeprogramowanie komórek skóry. Odkąd komórki iPS mogą być tworzone z własnej skóry pacjentów, staje się w końcu możliwe wyhodowanie komórek serca, które dokładnie pasują pacjentowi i nie będą odrzucone jeśli zostaną przeszczepione z powrotem do organizmu.
Jednakże wciąż jest wiele wyzwań do przezwyciężenia. Na przykład, każda bijąca komórka serca przeszczepiona do serca pacjenta musi bić zgodnie z całym sercem. Ważne jest też aby nauczyć się jak uzyskać tylko i wyłącznie odpowiednie komórki do przeszczepu. Zarówno embrionalne komórki macierzyste jak i komórki iPS są pluripotencjalne – mogę tworzyć wszystkie typy komórek występujące w ciele. Niestety kiedy te niewyspecjalizowane komórki przeszczepiane są do dorosłego osobnika mają tendencję do formowania guza. Bardzo istotne jest zatem aby oddzielić pluripotencjalne komórki macierzyste od wyspecjalizowanych komórek które mogą one tworzyć, jak na przykład kardiomiocyty. Tylko kardiomiocyty mogą być przeszczepione do pacjenta. Jedną ze strategii która pozwala na wybranie tylko kardiomiocytów jest zidentyfikowanie unikatowej kombinacji białek na powierzchni tych komórek, podobnie jak kod kreskowy. Tego typu metody pozwalające na dokładne i niezawodne wyselekcjonowanie określonego typu komórek są przedmiotem obecnych badań.
Przyszłość niesie wiele pytań, ale też nadziei. Czy będziemy mogli stymulować serce do tworzenia nowych mięśni u dorosłego pacjenta bez przeszczepiania komórek? Czy będziemy w stanie tworzyć kardiomiocyty w laboratorium i selekcjonować wyspecjalizowany podtyp komórek do przeszczepu, na przykład komórki bodźcotwórcze do wytworzenia rytmicznego samopobudzania się? Jak zmusić te przeszczepione komórki aby współgrały z sercem pacjenta? Aby odpowiedzieć na te pytania i rozwinąć nowe terapie, potrzebnych jest więcej badań nad zrozumieniem serca i mechanizmów które kontrolują tworzenie się nowych komórek serca. Na przykład, badania nad rybką Danio dostarczają nowych wskazówek: serce dorosłej rybki posiada niesamowitą zdolność do regeneracji (lub naprawy). Obecne badania wykazały także, że serce nowo narodzonej myszy może się zregenerować, ale ta zdolność jest tracona w trakcie dojrzewania myszy. Obecne badania sprawdzają dlaczego następuje zmiana (utrata) zdolności serca do samonaprawy; dogłębne zrozumienie tych procesów może ostatecznie doprowadzić do odkrycia nowych możliwości w leczeniu pacjentów poprzez włączenie mechanizmów samonaprawczych serca.
Praca nad rozwojem nowych terapii komórkowych lub bazujących na regeneracji wymaga czasu. W niedalekiej przyszłości naukowcy mają nadzieję używać kardiomiocytów wyhodowanych w laboratorium do testowania lub identyfikowania nowych lekarstw na serce.
Ostry zawał serca (atak serca) występuje, gdy część mięśnia sercowego obumiera lub ulega uszkodzeniu na skutek niewystarczającego dopływu tlenu. Zakrzep krwi powstaje w jednej z tętnic wieńcowych, w naczyniach krwionośnych, które dostarczają krew do serca. Ten zakrzep uniemożliwia dopływ krwi – i w związku z tym tlenu – do komórek serca w tym miejscu, powodując ich obumarcie.
Czasami tętnice zasilające serce z czasem stopniowo ulegają zwężaniu, na skutek narastającej obstrukcji. Ilość krwi, która może dostać się do tętnic i dotrzeć do serca, ulega ograniczeniu. W związku z tym, że krew przenosi tlen, serce nie jest w stanie otrzymać wymaganej ilości tlenu. Przewlekła choroba wieńcowa często prowadzi do ataku serca, gdy w miejscu zwężenia tętnicy utworzy się skrzep krwi.
Jeszcze kilka lat temu naukowcy uważali, że naprawa zniszczonego serca jest niemożliwa. Odkrycie sercowych komórek macierzystych, które miało miejsce trzy lata temu, otworzyło nowe możliwości wykorzystania komórek macierzystych do naprawy serca, które zostało uszkodzone na skutek ataku serca (ostrego zawału serca) lub przewlekłej choroby wieńcowej. Liczne badania przeprowadzone z wykorzystaniem zwierzęcych modeli choroby serca sugerują, że przeszczep komórek macierzystych szpiku kości do uszkodzonego serca może w rzeczywistości częściowo naprawić uszkodzone serce. W rezultacie prowadzonych jest obecnie wiele prób klinicznych przeszczepu szpiku kości na potrzeby leczenia chorób serca, a w szczególności ataków serca (ostrego zawału serca).
Ogólnie mówiąc, w ramach tych prób pacjenci, którzy przeszli atak serca, otrzymują preparaty składające się z komórek macierzystych ich własnego szpiku kostnego – są to tzw. przeszczepy autologiczne. Te próby wykazały, że ta terapia jest bezpieczna i odnotowano względną poprawę pracy serca. Jednak wielu naukowców uważa, że wnioski nie są spójne i nadal pozostaje wiele pytań dotyczących zasadności klinicznej oraz długotrwałego działania. W rezultacie naukowcy są zgodni, że postęp w dziedzinie tych prób klinicznych można osiągnąć, prowadząc badania na modelach zwierzęcych i komórkach hodowanych w laboratoriach.
Niektóre z pytań, na które naukowcy próbują odpowiedzieć, obejmują dokładne ustalenie, które komórki w szpiku kostnym (lub we krwi) mają wpływ na uszkodzone serce. Naukowcy badają również, czy komórki macierzyste szpiku kostnego stają się nowymi komórkami mięśniowymi serca oraz/lub komórkami naczyń krwionośnych, czy zapobiegają obumieraniu istniejących komórek serca lub czy uwalniają one substancje, które stymulują one istniejące komórki macierzyste serca do podziału i zastąpienia obumarłych komórek.
Interview with Christine Mummery: A physicist's take on stem cell biology
Image blog describing some recent research on zebra fish
How carbon dating works from How Stuff Works
Heart Hub, from the American Heart Association
National Heart Lung and Blood Institute, National Institutes of Health, USA
World Health Organization (WHO) page on cardiovascular diseases
Ta broszura informacyjna została stworzona przez Stefan Jovinge, koordynator projektu CardioCell. Fundowanego przez EC
Tłumaczenie na język polski: Mieszko Wilk.
Zdjęcia komórek wykonane przez Stefan Jovinge. Tytułowe zdjęcie serca wykonane przez Gordon Museum/Wellcome Images. Zdjęcie testów nuklearnych dzięki uprzejmości National Nuclear Security Administration / Nevada Site Office.