Enfermedad de las motoneuronas: ¿cómo podrían ayudar las células madre?
Las enfermedades de la motoneurona (EMN) son un trastorno poco frecuente pero debilitante y a la larga mortal. Actualmente no existe tratamiento que pueda parar la progresión de estas enfermedades, aunque se ha demostrado que un tratamiento autorizado ha conseguido extender la esperanza de vida, pero solo por unos meses. Necesitamos urgentemente enfoques terapéuticos nuevos y efectivos que consigan modificar o alterar la progresión de la enfermedad y revertir el daño que la enfermedad de neuronas motoras causa al sistema nervioso. ¿Cómo podrían ayudar las células madre?
El conjunto de diferentes enfermedades causadas por daños en las células nerviosas (neuronas) que controlan nuestros músculos se denominan enfermedades de la motoneurona (EMN). Actualmente no existe ninguna cura para la EMN, por lo que la mayoría de tratamientos están enfocados en mejorar la calidad de vida de los pacientes.
Aproximadamente un 10 % de los casos de las EMN se heredan de padres a hijos. Sin embargo, sigue sin conocerse la causa de la mayoría de casos (90 %).
Hay muchas células en el cerebro que sirven de apoyo a las neuronas y las ayudan a funcionar. Existen cada vez más pruebas de que si estas células de apoyo dejan de funcionar, las motoneuronas son susceptibles de padecer daños.
Los investigadores están utilizando células madre para desarrollar métodos para cultivar neuronas y otro tipo de células en cultivopara recrear (o «modelar») las EMN. Esto ayuda en gran medida a los investigadores a estudiar y descubrir las causas de las lesiones neuronales y cómo podrían prevenirse. Los modelos de cultivo de células madre también son muy útiles para identificar nuevos fármacos y comprobar la seguridad y eficacia de nuevos tratamientos.
También se están desarrollando células madre como tratamientos para pacientes con EMN. Puede que las células madre sean capaces de regular las respuestas inmunes o incluso producir factores de crecimiento que ayuden a las neuronas a sobrevivir y a autorepararse.
Debido a la complejidad y a las múltiples facetas de esta enfermedad, los investigadores conocen relativamente poco sobre las EMN. Este grado de complejidad también implica que los tratamientos de las EMN deben rectificar simultáneamente muchos cambios en el cuerpo para ser eficaces a la hora de detener un daño mayor al sistema nervioso.
Reparar los daños causados por las EMNsupondrá un reto importante. Los investigadores están estudiando las diferentes formas en las que podrían utilizar las células madre para reparar el sistema nervioso cultivando nuevas neuronas y células de apoyo. Para restablecer totalmente la funcionalidad del mismo, estas nuevas células también deben integrarse adecuadamente en la red de células que forma el sistema nervioso.
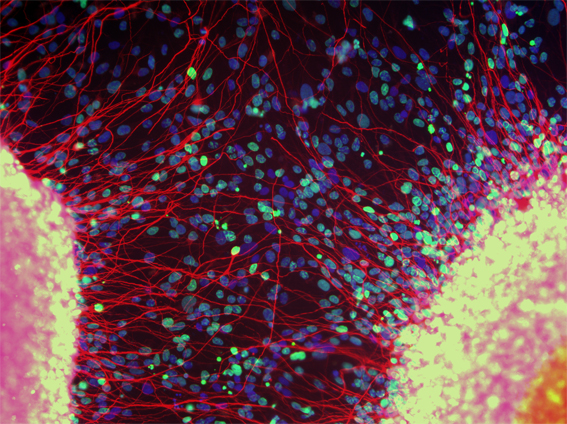
Las enfermedades de la motoneurona comprende un grupo de afecciones que afectan a las células del sistema nervioso, lo que en última instancia conduce a la degeneración de las células que conforman las vías motoras- las motoneuronas. Las vías motoras generan y controlan el movimiento al transmitir las señales eléctricas desde las motoneuronas del cerebro y de la médula espinal (sistema nervioso central o SNC) a los músculos mediante sinapsis (conexiones) con las neuronas motoras periféricas (sistema nervioso periférico o SNP). Las motoneuronas periféricas transmiten señales desde el cerebro hasta los músculos a través de una sinapsis llamada unión neuromuscular (UNM). En las EMN, estas neuronas enferman y mueren, lo que conduce a una parálisis progresiva (incapacidad para moverse). Hay cuatro tipos principales de EMN, que afectan de manera variable a las rutas de señalización motrices del Sistema nervioso central (SNC) y del Sistema Nervioso Periférico (SNP) (también conocido como sistema ‘superior’ e ‘inferior’ respectivamente). Personas con EMN pueden experimentar una variedad de síntomas que incluyen (entre otros) debilidad muscular, rigidez muscular y dificultades para hablar, tragar e incluso respirar. Generalmente con el tiempo, se pierde masa muscular, empeorando los síntomas progresivamente. Existe mucha superposición en las manifestaciones clínicas entre las diversas EMN, lo que dificulta el diagnóstico de un tipo específico en las personas afectadas por estas enfermedades. La forma más común de aparición en adultos de las EMN es la esclerosis lateral amiotrófica (ELA), que afecta a rutas de señalización del SNC y del SNP y representa aproximadamente el 60-70% de todos los casos. En los EE.UU. se conoce generalmente como 'enfermedad de Lou Gehrig' y afecta a aproximadamente 7 de cada 100,000 personas.
Algunas formas de ELA son hereditarias o "familiares", lo que significa que se transmiten genéticamente de una generación a la siguiente. Alrededor del 10% pertenecen a esta categoría. Se descubrió que la primera forma "genética" de ELA fue el resultado de una mutación en el gen que codifica la enzima superóxido dismutasa 1 (SOD1). Clínicamente, las personas portadoras de esta mutación se presentan de manera muy similar a aquellas en las que no se ha identificado ninguna causa y sin razón genética (ELA "esporádica"), lo que sugiere mecanismos compartidos de progresión de la enfermedad. Desde este descubrimiento, muchas otras mutaciones causantes de ELA, tanto en SOD1 como en una docena de otros genes, han sido identificadas, lo que lleva a una multitud de hipótesis sobre cómo se desarrolla la enfermedad. En general, las formas hereditarias de la enfermedad neurodegenerativa se manifiestan de una forma temprana, pero en los casos esporádicos de ELA, la enfermedad puede aparecer en adultos de cualquier edad. Curiosamente, un trastorno muy similar a la ELA en perros, conocido como mielopatía degenerativa canina (MCD), se debe en gran medida a mutaciones en el gen SOD1. El perro podría convertirse en una pieza crítica del rompecabezas para comprender los mecanismos de la ELAy explorar nuevos tratamientos. Esto se debe a que la MCD se desarrolla de una forma natural en esta especie y a que los perros y los humanos están expuestos a factores ambientales y de estilo de vida similares.
La gran mayoría de las personas con ELA presentan una forma esporádica o no hereditaria de la enfermedad, que se cree que es causada por una combinación de factores genéticos y ambientales. Los factores ambientales específicos responsables del desarrollo de la enfermedad aún no han sido identificados. Los científicos creen que las vías motoras dejan de funcionar no solo por los cambios dentro de células afectadas, sino también por el daño causado a otros tipos de células de apoyo situadas en su entorno. Cada vez hay más pruebas de que estas células, las "glía" del sistema nervioso, desempeñan un papel fundamental, tanto en la salud como en la enfermedad. En el SNC, las categorías principales de glía comprenden los astrocitos, oligodendrocitos y microglia. Cada una de estas células tiene funciones diferentes, algunas de las cuales actualmente se comprenden bien; por ejemplo, la microglia funciona como las células inmunes del SNC, mientras que los oligodendrocitos son responsables de producir la vaina de mielina que rodea los axones neuronales, lo que permite una rápida transmisión de señales eléctricas. En el SNP, las células de Schwann desempeñan el papel del oligodendrocito. Las glías responden rápidamente a las lesiones neuronales, pero no siempre con respuestas deseables. Igualmente, debido a sufuncioón de apoyo, la glía con deficiencias puede provocar que las neuronas y las células nerviosas sean más vulnerables a las lesiones. Además, hay evidencias que sugieren que los primeros signos de enfermedad ocurren en la UNM, donde las neuronas motoras se conectan al músculo. La degradación en la UNM ocurre antes de la aparición de los síntomas y se propaga desde la UNM a través del SNP y el SNC. La intervención temprana en la UNM podría retrasar o prevenir la degradación progresiva.
Hasta la fecha no hay cura para ninguna forma de ELA. Los enfoques terapéuticos actuales se centran en aliviar los síntomas o en proporcionar ayudas tecnológicas y funcionales para mejorar la calidad de vida (por ejemplo, el proyecto de la universidad de Edimburgo llamado Speak:Unique - el Proyecto de Investigación Voicebank). El primer y único tratamiento disponible con licencia para su uso en el sistema nacional de salud del Reino Unidoque ha demostrado alterar la progresión en algunas personas con ELA, es el medicamento llamado riluzol. Actualmente no se sabe cuál de las muchas acciones del riluzol proporciona efectos beneficiosos en la ELA; Independientemente, estos efectos son muy limitados, extendiendo la supervivencia por solo 2 a 3 meses. Los científicos y los profesionales clínicos están buscando activamente tratamientos más efectivos.
Durante la última década, los avances científicos han permitido un enorme progreso en la investigación de la ELA, sin embargo aún se conoce relativamente poco sobre cómo y por qué en la ELA las vías motoras se degeneran. Una gran cantidad de distintos factores parecen estar involucrados en la aparición y progresión de la enfermedad. Un enfoque terapéutico efectivo debería abordar la gran mayoría, sino todos, de los cambios dañinos que ocurren simultáneamente en el cuerpo. Por lo tanto, es probable que se necesite una combinación de tratamientos para detener o retrasar la progresión de la enfermedad. Un desafío mucho más difícil será encontrar tratamientos que luego puedan reparar el sistema nervioso dañado y revertir los síntomas incapacitantes.
En la actualidad, los científicos están utilizando células madre humanas para modelar la ELA en el laboratorio, con el objetivo de investigar en más detalle sobre los mecanismos celulares y moleculares que subyacen a la ELA. Además, estos cultivos pueden utilizarse para examinar nuevos tratamientos. También están investigando si estas células madre humanas pudieran tener un uso terapéutico. Hay varios tipos de células madre que ofrecen diferentes posibilidades para la investigación y terapias.
1. Uso de sistemas derivados de células madre para estudiar y comprender la ELA
Las células afectadas por la ELA están ubicadas en el sistema nervioso, al cual es difícil acceder. Esto significa que la ELA es muy difícil de estudiar en individuos afectados y existe una gran limitación para obtener muestras de células dañadas para un examen más detenido en el laboratorio. Los esfuerzos iniciales se han centrado en el uso de células madre embrionarias para estudiar la enfermedad. En 2008, un equipo de científicos de la Universidad de Harvard, en los EE. UU., utilizó células de la piel de una persona con ELA para abordar este problema. Los investigadores primero transformaron las células de la piel en células madre pluripotentes inducidas (células iPS). Las células iPS son células que se han reprogramado artificialmente para convertirse en células madre pluripotentes (células que pueden producir más de sí mismas y también cualquier tipo de célula en el cuerpo). Las células iPS se utilizaron para fabricar neuronas motoras, lo que representa una nueva oportunidad para utilizar células humanas trascendentales para estudiar la ELA. Usando un método similar, los científicos de la Universidad de Edimburgo generaron neuronas motoras en el laboratorio a partir de un individuo que porta una mutación genética que causa la ELA. Estas neuronas motoras murieron mucho antes que las neuronas motoras generadas a partir de la piel de un voluntario sano, imitando así la ELA en una placa de laboratorio.
Los sistemas celulares derivados de células iPS proporcionan una herramienta poderosa para observar las células humanas en el contexto de la enfermedad, descubrir nuevos detalles mecánicos de cómo podría progresar la enfermedad y examinar cómo los diferentes tipos de células del sistema nervioso influyen entre sí. Al generar glía a partir de las células iPS y hacer que crezcan de forma aislada y junto con las neuronas motoras, los investigadores pueden comenzar a descubrir el papel de estas células en la ELA y evaluar si estas podría usarse como terapia. Además, el crecimiento de las neuronas motoras junto con las células musculares puede producir un UNM "en un cultivo", lo que permite estudiar cómo se interrumpen las señales neuronales y los músculos durante la enfermedad y tal vez encontrar formas de mejorar y preservar estas señales durante la misma. Finalmente, una ventaja importante de la tecnología iPS es que se pueden generar células de personas con diferentes formas de ELA para comprender mejor las similitudes y diferencias entre estos trastornos, que probablemente requieran regímenes de tratamiento específicos. Aunque aún no se ha demostrado, la tecnología iPS podría aplicarse para investigar trastornos similares en otras especies, por ejemplo, MDC en perros, lo que podría proporcionar un puente éticamente viable para traducir los descubrimientos del laboratorio a la clínica.
2. Empleo de sistemas derivados de células madre para la identificación de medicamentos
La capacidad de hacer crecer grandes cantidades de neuronas motoras derivadas de células madre y otras células relevantes para la enfermedad en un cultivo de laboratorio permite a los científicos analizar miles de medicamentos que podrían tratar la ELA. Estos pueden ser medicamentos completamente nuevos o compuestos que ya han sido autorizados para su uso en humanos para otros trastornos. De esta manera, los "medicamentos antiguos" podrían ser reutilizados rápidamente para la enfermedad de las motoneuronas, al llevarlos rápidamente a fases posteriores de investigación clínica sin la necesidad de estudios pre-clínicos prolongados y costosos. La tecnología iPS también puede eventualmente abrir una puerta de entrada a la "medicina de precisión" para tratar la enfermedad, ya que permite diseñar un tratamiento a medida para un individuo, según la forma en que sus células responden a un tratamiento en cuestión en el laboratorio.
3. ¿Usar células madre humanas como terapia para la ELA?
La posibilidad de utilizar neuronas derivadas de células madre como una terapia de reemplazo de células para tratar la ELA sigue siendo un gran desafío conceptual, técnico y ético. Una razón es la complejidad de los circuitos dentro del sistema nervioso y la necesidad de que cualquier célula de reemplazo forme las interacciones funcionales correctas con las células existentes. Estos complejos circuitos se desarrollaron y refinaron originalmente durante el desarrollo del individuo para permitir el control preciso del movimiento, a través del "aprendizaje motor". Cualquier célula nueva tendría que "aprender" a jugar dentro del circuito sin interrumpir los objetivos de ese circuito, ya que en cualquier red compleja hay muchas posibilidades de que las cosas salgan mal. Como se mencionó anteriormente, también hay muchos factores que contribuyen a la neurodegeneración en la ELA, incluido un entorno celular potencialmente tóxico. Cualquier célula trasplantada, aún estando sana, simplemente puede degenerar al estar expuesta a estos mismos factores. Un uso alternativo para las células madre humanas en la ELA podría ser el trasplante de células que puedan ayudar a la supervivencia y la función de las neuronas motoras restantes y / o modificar el entorno al que están expuestas. De esta manera, los científicos esperan proteger las vías motoras de un daño mayor y extender su supervivencia, lo que a su vez retardaría la progresión clínica de la ELA. Esta idea es conceptualmente más práctica y actualmente se están probando varios tipos de células madre para esta aplicación.
En la actualidad, la principal utilidad de las células madre en el contexto de la ELA es el modelado de la enfermedad. El trasplante de células madre sigue siendo una vía para futuras investigaciones; los estudios preliminares sugieren que el procedimiento es seguro e incluso puede conferir algún beneficio, aunque esto aún no se ha confirmado en grupos más grandes de pacientes con ELA. Los ensayos clínicos para la ELA se enfrentan a los muchos desafíos bien reconocidos que se aplican a cualquier condición, con las preocupaciones éticas adicionales de reclutar a personas que tienen una esperanza de vida corta y que buscan urgentemente tratamientos que modifiquen la enfermedad. Existe la preocupación adicional de que los diseños de ensayos clínicos establecidos como el "modelo de referencia" (incluida la asignación aleatoria de tratamientos a diferentes grupos, la inclusión del doble cegamiento y el uso de placebos) simplemente no son prácticos ni éticos para algunos estudios que involucran a personas con ELA. Esto disminuye inherentemente la confianza en los resultados de estos ensayos. Los ensayos clínicos actuales tienen como objetivo identificar el tipo más idóneo de células madre, los métodos de administración y las dosis eficaces y seguras.
Es importante tener en cuenta que aunque las terapias basadas en células madre son prometedoras en modelos animales, no hay pruebas suficientes de ningún beneficio para el tratamiento de la ELA.
Las células madre estromales o mesenquimatosas (MSC por sus siglas en inglés) son células madre adultas que pueden aislarse fácilmente de la médula ósea y cultivarse en el laboratorio. Las MSC son fáciles de propagarse en grandes cantidades y secretar factores que pueden actuar para reprimir el sistema inmunológico. Por esta razón, se han identificado como candidatos potencialmente prometedores para terapias basadas en células, ya que pueden ayudar a regular las respuestas inmunitarias en personas con ELA Además, en el laboratorio, estas células madre pueden convertirse en MSC-NTF (MSC que secretan factores neurotróficos). Estas son células más especializadas que pueden producir factores de crecimiento que ayudan la supervivencia de las neuronas.
En ensayos clínicos en humanos, los estudios de Fase I (la Fase I es un ensayo clínico centrado en evaluar la seguridad de un tratamiento) han demostrado que el trasplante de MSC en personas con ELA administrados mediante diversos métodos (inyecciones en la médula espinal o sangre) no tiene efectos nocivos importantes. En 2016, una empresa estadounidense llamada Brainstorm Cell Therapeutic probó el trasplante de células MSC-NTF en un ensayo clínico de fase II (para evaluar si un tratamiento previamente evaluado como seguro tiene un beneficio clínico posterior) con el objetivo de evaluar su seguridad y eficacia en un grupo más grande de personas con ELA. El ensayo mostró que estos tipos de células madre son seguros cuando se inyectan en el brazo y la médula espinal y que la progresión de la enfermedad se desaceleró en algunos pacientes (ClinicalTrials.gov NCT02017912). Se está llevando a cabo un ensayo clínico de fase III más grande (que evalúa la eficacia clínica del tratamiento en un grupo mucho mayor de pacientes). (Clinicaltrials.gov NCT03280056).
Las células madre neurales (NSC por sus siglas en inglés) son células madre especializadas que pueden dar lugar a todos los tipos de células del sistema nervioso. En el cerebro sano, la glía proporciona apoyo a las neuronas y participa activamente en las funciones neuronales. Sin embargo, en las personas con ELA, las células gliales pueden perder estas funciones críticas e incluso volverse perjudiciales para las neuronas motoras. Las NSC trasplantadas ofrecen la oportunidad de modificar el entorno potencialmente dañino en el que viven las neuronas motoras. En estudios de laboratorio, la inyección directa de NSC en las médulas espinales de modelos de ratas con ELA aumentó la supervivencia de las neuronas motoras en los sitios de trasplante. Se ha demostrado que los primeros estudios que implican el trasplante de NSC en personas con ELA se toleran sin efectos secundarios importantes. Algunos pacientes comunicaron una progresión de la enfermedad o una mejoría clínica más lenta (ClinicalTrials.gov NCT01348451). Sin embargo, debido al pequeño número de personas inscritas en esta Fase I, el estudio de seguridad de etiqueta abierta, estos resultados secundarios positivos deben interpretarse con cautela. Una compañía llamada NeuralStem Inc. está llevando a cabo un ensayo de fase II en 18 personas con MND (ClinicalTrials.gov NCT01730716), que confirma que el trasplante de estas células es seguro, pero aún se está investigando el beneficio de estos tratamientos.
Además de las NSC, las células progenitoras restringidas a la glía (GRP por sus siglas en inglés) y las células progenitoras neurales (NPC por sus siglas en inglés) también pueden producir células gliales después del trasplante. En particular, las NPC han sido diseñadas para producir de manera estable un factor de crecimiento (factor neurotrófico derivado de la línea celular glial, GDNF por su siglas en inglés) para mejorar su ayuda a las neuronas motoras. El trasplante de estos dos tipos de células madre en modelos de roedores con ELA dio como resultado un aumento de la supervivencia de las neuronas motoras, lo que mejoró el movimiento y el tiempo de supervivencia. El trasplante de estas células madre se encuentra ahora en las primeras etapas de los ensayos clínicos de Fase I (ClinicalTrials.gov NCT02943850).
Fases clave de la investigación clínica
Estúdios pre-clínicos | Pruebas de laboratorio para estudiar la eficacia biológica y la toxicidad de un nuevo tratamiento con células en un cultivo celular de especies animales no humanas |
Fase I del ensayo clínico | Probar la seguridad y la tolerabilidad de un nuevo tratamiento o medicamento en un pequeño número de voluntarios humanos sanos para establecer el rango de dosis y / o la técnica. Estos estudios "primero en humanos" a veces se realizan directamente en personas con ELA ya que la intervención es demasiado invasiva para probar en voluntarios sanos. |
Fase II del ensayo clínico
| Determinar la eficacia y seguridad biológica de un medicamento o tratamiento con dosis / técnicas establecidas en un pequeño número de personas con la condición de interés |
Fase III del ensayo clínico
| Probar la eficacia biológica, la eficacia terapéutica y la seguridad de un fármaco o un tratamiento terapéutico en un gran número de personas con la condición de interés (el modelo de referencia es un ensayo multicéntrico, aleatorizado, doble ciego y controlado con placebo). Normalmente, un resultado clave es probar si el nuevo tratamiento es más beneficioso que los tratamientos existentes |
Tenga en cuenta que solo alrededor de 1 de cada 5000 nuevos compuestos para medicamentos llegan a la etapa de aprobación de la FDA. El tiempo que se tarda en hacer la transición de un nuevo medicamento desde el laboratorio hasta la clínica es de unos 12 a 18 años y el costo supera los mil millones de dólares estadounidenses.
Diccionario de abreviaciones y significados
Abierto | Diseño de ensayo clínico en el que ni el investigador ni el participante están cegados al tratamiento administrado. Algunos ensayos de MND son necesariamente de "etiqueta abierta" |
Aleatorización
| En el contexto del diseño de ensayos clínicos, esto se refiere a la asignación aleatoria de personas a diferentes grupos de tratamiento, incluido el grupo que recibió un placebo o ningún tratamiento. Un intento de reducir el sesgo de selección. |
Auto-renovación | La capacidad de replicarse a uno mismo. |
Axon
| La proyección larga y delgada de una neurona o célula nerviosa que conduce las señales eléctricas desde el cuerpo celular a una neurona vecina, célula nerviosa u órgano / tejido efector, p. ej. músculo. |
Cegador
| En el contexto del diseño de ensayos clínicos, el "cegamiento" intenta eliminar algunas fuentes de sesgo potencial. Un estudio "ciego simple" es aquel en el que el participante no sabe qué tratamiento se le está administrando; En un estudio "doble ciego", tanto el investigador como el participante desconocen qué tratamiento se está administrando. Los ensayos clínicos más robustos son "doble ciego". Algunos ensayos clínicos de ELA se han diseñado necesariamente como "etiqueta abierta" de manera que no haya cegamiento. |
Célula de Schwann
| Un tipo de célula glial encontrado en el SNP; Su función principal es producir la vaina de mielina que rodea los axones de las neuronas PNS. |
Célula glial | Un tipo de célula de apoyo en el sistema nervioso que tiene funciones importantes en la salud y la enfermedad; plural "glia". Los principales tipos de glia en el SNC son los astrocitos, oligodendrocitos y microglia. |
célula iPS | Una célula madre pluripotente derivada artificialmente de una célula no pluripotente (por ejemplo, una célula de la piel) mediante la reprogramación celular: la expresión forzada de los genes de la pluripotencia. |
ELA
| Esclerosis lateral amiotrófica ( sinónimo de la enfermedad de la neurona motora" y "enfermedad de Lou Gehrig") |
ELA familiar | Sinónimo de 'ELA heredada'; una forma de ELA con una causa genética definida que puede transmitirse de una generación a la siguiente. |
ELA heredada
| Sinónimo de 'ELA familiar'; una forma de ELA con una causa genética definida que puede transmitirse de una generación a la siguiente. |
ELA esporádica
| Una forma de ELA en la que no se ha identificado una causa específica.
|
EMN
| Enfermedades de la neurona motora (sinónimo de "esclerosis lateral amiotrófica y" enfermedad de Lou Gehrig " en UK, pero no en otros paises); soncondicionesneurológicas debilitantes que resultan en la degeneración de las neuronas motoras en el cerebro y la médula espinal que conduce a debilidad muscular, pérdida de movilidad y dificultades para hablar, tragar y respirar. |
GRP | progenitor restringido glial; una célula progenitora que solo puede diferenciarse en varios tipos de células gliales. |
MCD
| Mielopatía degenerativa canina; un trastorno neurodegenerativo natural en perros que demuestra la superposición genética, clínica y patológica con algunas formas de ELA humana. |
Medicina de precisión
| La personalización de la asistencia sanitaria, adaptada a la persona. |
Mielina
| La mielina es la vaina grasa (producida por oligodendrocitos en el SNC y células de Schwann en el SNP) que envuelve los axones neuronales. La mielina desempeña un papel en el apoyo y la protección de la función neuronal y es fundamental para la transmisión rápida de señales neuronales. |
Multipotente | Una célula madre multipotente tiene la capacidad de auto renovarse y diferenciarse en un número restringido de diferentes tipos de células, p. ej. células madre neurales. Las células progenitoras o precursoras son generalmente multipotentes |
Mutación
| En el contexto de la genética, esto significa un cambio en el ADN que codifica un gen, un mensaje que se traduce en una proteína. Algunas mutaciones son efectivamente inocuas y por lo tanto no causan enfermedades; otros pueden alterar dramáticamente la estructura y el funcionamiento de una proteína o evitar que se produzca por completo, interrumpiendo la función y causando consecuencias clínicas. |
Neurodegeneración
| Pérdida progresiva de la estructura o función de las neuronas y / o nervios, lo que finalmente resulta en su muerte. |
Neurona
| Una célula especializada que transmite impulsos eléctricos dentro de los sistemas nerviosos central y periférico. Existen diferentes tipos de neuronas, como las neuronas motoras o las neuronas sensoriales. |
Neurona motora | Una célula eléctricamente activa que desempeña un papel en el control del movimiento mediante la activación de las células musculares |
NPC
| Célula precursora neural; una célula multipotente que puede replicarse con un número limitado de divisiones y también puede producir los diferentes tipos de células del sistema nervioso. Un NPC es por lo tanto más restringido que un NSC. |
NSC | Célula madre neural; un tipo de célula multipotente que puede replicarse indefinidamente y producir todos los demás tipos de células dentro del sistema nervioso. |
NTF
| Factor neurotrófico; Una biomolécula que apoya el crecimiento, la supervivencia, la diferenciación y el mantenimiento de las neuronas. |
Oligodendrocito
| Un tipo de célula glial encontrado en el SNC; Su función principal es producir la vaina de mielina que rodea los axones de las neuronas del SNC. |
Parálisis
| Pérdida de la capacidad de iniciar o generar movimiento. |
Placebo
| Un control de tratamiento que pretende simular un tratamiento real en todos los aspectos, excepto que es inerte biológica o médicamente. Un control que tiene como objetivo eliminar el sesgo asociado con el "efecto placebo" en el que una persona que recibe un tratamiento ineficaz tendrá una mejoría percibida o real en su condición. |
Pluripotente | Una célula pluripotente tiene la capacidad de diferenciarse en cualquier tipo de célula en el cuerpo. Una célula madre pluripotente también puede auto renovarse indefinidamente. |
Sinapsis | Una unión entre dos células eléctricamente activas. |
SNC | Sistema nervioso central; un sistema de neuronas y glía dentro del cerebro, el tronco encefálico y la médula espinal que desempeña muchas funciones, incluida la coordinación de la función nerviosa periférica. Una neurona motora que se sincroniza con otra neurona motora dentro del SNC o un nervio motor periférico dentro delSNP a veces se conoce como una "neurona motora superior". |
SNP
| Sistema nervioso periférico; un sistema de neuronas y glía que transmite información fuera del cerebro y la médula espinal y conecta estas regiones eléctricamente a los tejidos periféricos, incluido el músculo. Una neurona motora que conduce señales desde el tronco encefálico o la médula espinal hacia el músculo a veces se denomina "neurona motora inferior". |
SOD1 | Superóxido dismutasa 1; Una enzima antioxidante. Las mutaciones en el gen que codifica SOD1 son responsables de una pequeña proporción de ELA familiar. |
UNM | La sinapsis entre una neurona motora periférica y un músculo, donde los impulsos eléctricos de la neurona motora se transmiten al músculo para controlar el movimiento. |
Esta publicación fue creada por Christine Weber.
Revisado en 2012 por Siddharthan Chandran y Rebecca Devon.
Revisado y actualizado en 2015 por Chen Zhao y Nina Rzechorzek.
Revisado en 2016 por Rebecca Devon, Belinda Cupid and Laura Stephenson.
Revisado y actualizado en 2018 por Claire Hetherington.
Traducido al castellano por Balta Lucendo Villarin y Vania Rosas.
La imagen de las células madre neurales humanas ha sido cedida por cortesía de la Clínica de Neurología Regenerativa Anne Rowling. La imagen de las neuronas motoras derivadas de células iPS han sido cedidas por cortesía de Gist Croft y Mackenzie Weygandt, ganador de la competición ´BioScapes Olympus Digital Imaging ®`en el 2009.