Distrofia muscular: ¿cómo podrían ayudar las células madre?
La distrofia muscular es una enfermedad degenerativa del músculo que se presenta en distintas formas. Aproximadamente 1 de cada 3.500 niños en el mundo nace con la forma más común de la enfermedad, la distrofia muscular de Duchenne. ¿Cómo podría la investigación con células madre desarrollar nuevos tratamientos?
Las distrofias musculares son un grupo de enfermedades genéticas que causan el debilitamiento y el deterioro progresivo del corazón y los músculos esqueléticos.
Las personas que padecen la distrofia muscular de Duchenne (DMD), carecen de una proteína llamada distrofina, lo que hace que sus músculos se dañen fácilmente. El daño muscular puede provocar inflamaciones que a su vez dañan el tejido muscular.
Normalmente, las células madre musculares, llamadas «células satélite», fabrican mioblastos que reparan las fibras musculares dañadas. Sin embargo, estas células satélite tienen dificultades para fabricar suficientes mioblastos en los pacientes con DMD y se agotan rápidamente.
Los investigadores están estudiando minuciosamente las células satélite y las causas de los daños musculares. También estudian los tratamientos que ayudan a reducir dichos daños, como los tratamientos antiinflamatorios.
Existen estudios que están examinando las maneras de preservar, y posiblemente restaurar, la función muscular trasplantando células productoras de distrofina a pacientes. Estas células podrían ser células de donantes sanos o células del propio paciente modificadas genéticamente.
Actualmente, se está considerando la opción de usar células madre pluripotentes inducidas (iPSC) para obtener células con los genes de la distrofina sanos en grandes números.
Uno de los grandes retos de los tratamientos que implican trasplantar células de donantes es el posible rechazo del trasplante por parte del sistema inmunitario del paciente. Tratar a los pacientes con sus propias células (ya sean células genéticamente modificadas o iPSC) podría solventar en gran parte el problema del rechazo del trasplante, pero podrían surgir otros riesgos.
Otro de los grandes retos es la integración de las células. La mayoría de los músculos del paciente están debilitados y necesitan tratamiento. Distribuir las células de manera uniforme por los músculos de todo el cuerpo supone un gran reto para el tratamiento con terapia celular. A día de hoy, las terapias celulares no tienen una tasa de éxito elevada porque la proporción de células sanas (o corregidas genéticamente) que se trasplantan al paciente es baja en comparación con las células enfermas ya existentes en el paciente.

Las distrofias musculares son un grupo de enfermedades genéticas que afectan a los músculos esqueléticos y frecuentemente a los cardiacos. Los síntomas incluyen debilidad muscular y degeneración muscular progresiva. La distrofia muscular de Duchenne (DMD) es la forma más común y una de las más graves de la enfermedad. La causa un defecto genético que impide la producción de una proteína llamada distrofina. La falta de distrofina hace que los músculos se vuelvan frágiles y se lastimen fácilmente. A lo largo del tiempo se acumula tanto daño que el cuerpo no lo logra reparar y los músculos degeneran, causando una discapacidad progresiva en los pacientes.
La mayor parte de un músculo está formada por haces de fibras de células musculares (células alargadas que contienen muchos núcleos), pero los músculos también contienen muchos otros tipos de células, incluyendo células madre. Las células madre forman parte del sistema natural de reparación del cuerpo. Pueden generar otros tipos de células (incluyendo células progenitoras) y también pueden copiarse a sí mismas. Los músculos esqueléticos contienen un tipo particular de células madre llamadas células satélite. Cuando las fibras musculares se dañan, emiten señales químicas a las células satélite indicándoles que generen nuevas fibras musculares o que se fusionen con fibras existentes para reparar el daño. Al mismo tiempo algunas células satélite hacen copias de sí mismas para asegurar que en el futuro sigan existiendo suficientes células madre que continúen reparando y reemplazando las fibras musculares.
Los científicos creen que dado que los músculos se dañan continuamente en la DMD la carga de reparación que recae sobre las células satélite es tan alta que éstas quedan agotadas y pierden la habilidad de copiarse a sí mismas. Las células satélite son esenciales para reparar el músculo por lo que a medida que la cantidad de estas células disminuye, el músculo va perdiendo la capacidad de repararse. En cambio, las fibras musculares dañadas se reemplazan por células grasas y tejido cicatrizante, debilitando el músculo hasta tal punto que éste no puede trabajar más de manera efectiva.
Actualmente no hay cura definitiva para la DMD. Los tratamientos se dirigen a fortalecer los músculos del paciente y a reducir algunos síntomas de la enfermedad. Para ralentizar la degeneración muscular comúnmente se utilizan esteroides, pero éstos tienen numerosos efectos secundarios, incluyendo debilitamiento óseo que lleva a la osteoporosis, hipertensión y crecimiento retardado. La fisioterapia puede ayudar parcialmente a mantener la fuerza y la flexibilidad muscular. Los investigadores esperan, en un futuro, ser capaces de reparar o reemplazar las fibras musculares dañadas usando diversas estrategias, incluyendo el trasplante de células productoras de distrofina para restablecer, o al menos preservar, la función muscular.
Existen diversos tipos de células madre que los científicos creen que podrían usarse de distintos modos para desarrollar tratamientos para la distrofia muscular. Las principales estrategias basadas en células madre que se investigan actualmente son:
- Generar fibras musculares sanas: Los científicos esperan que si se logran trasplantar a los músculos de los pacientes afectados células madre que no tengan los defectos genéticos que causan la DMD , éstas podrían generar fibras musculares funcionales que reemplacen las dañadas del paciente.
- Reducir la inflamación: Los músculos dañados en la distrofia muscular se inflaman considerablemente y esta inflamación acelera el proceso de degeneración muscular. Los científicos creen que ciertos tipos de células madre pueden liberar agentes químicos que reducen la inflamación, retrasando el avance de la enfermedad.
Además de las células madre, otras estrategias terapéuticas tales como la terapia génica o fármacos de molécula pequeña (compuestos orgánicos de bajo peso molecular) para reparar el gen dañado, se están probando en pacientes y en modelos preclínicos. Próximas terapias probablemente combinarán más de una de estas estrategias. Los científicos también están estudiando el papel de las células madre en el mantenimiento y la reparación de los músculos sanos para entender en mayor detalle las alteraciones que ocurren en la distrofia muscular y cómo corregirlas.
Gran parte de la investigación actual se centra en desarrollar métodos para restaurar la producción de la proteína ausente, la distrofina, en los músculos de pacientes con DMD.
Mioblastos
Los mioblastos son un tipo de células que se forman a partir de las células satélite. Los mioblastos se fusionan entre sí para formar fibras musculares. Cuando se inyectan estas células en los músculos de ratones con daño similar al causado por la DMD, los mioblastos de donantes sanos se fusionan con los enfermos y se logra restaurar parcialmente la producción de distrofina. Sin embargo, los ensayos clínicos demostraron que el trasplante de mioblastos no es eficiente en el tratamiento de músculos humanos, debido a su gran tamaño. Sólo una pequeña fracción de los mioblastos trasplantados sobreviven cuando se inyectan en músculos distróficos y, si provienen de un donante, son atacados por las células inmunes e inflamatorias del propio paciente, causando rechazo.
También hay problemas prácticos: aunque los mioblastos pudiesen llegar a ser útiles como parte de tratamientos para ciertos tipos de distrofias que afectan únicamente a un área pequeña y específica del cuerpo (como se ha demostrado recientemente en casos de distrofia muscular oculofaríngea) , la DMD afecta a la mayor parte del cuerpo. Es por ello que el tratamiento con inyecciones intramusculares es un reto, ya que las células no migran lejos del lugar de la inyección, por lo que se necesitaría administrar miles de inyecciones.
Obtener la gran cantidad de células necesarias para el trasplante y después suministrar las mismas en todos los músculos sería un desafío extremo. Alternativamente, para tratar todos los músculos, las células tendrían que inyectarse en el torrente sanguíneo para así ser distribuidas por todo el cuerpo. Sin embargo, los mioblastos no se pueden distribuir de esta manera ya que no pueden atravesar las paredes de los vasos sanguíneos y por lo tanto no pueden viajar desde los vasos sanguíneos hacia los músculos de su entorno.
Mesoangioblastos
Los mesoangioblastos (MAB) son un tipo de “células progenitoras” que se encuentran en las paredes de los vasos sanguíneos. Los investigadores han mostrado que los mesoangioblastos sanos pueden formar fibras musculares productoras de distrofina en perros y ratones con distrofia muscular. El grado en el cual la formación de nuevas fibras revirtió la degeneración muscular varió de animal a animal. Lo que es más importante, los MAB pueden atravesar las paredes de los vasos sanguíneos, por lo tanto pueden distribuirse a todos los músculos del cuerpo mediante una inyección en el torrente sanguíneo arterial.
Un ensayo clínico de fase temprana I/II se ha completado con 5 pacientes en Italia. Este ensayo ha demostrado que los MAB de donantes sanos son seguros para usarse en el tratamiento de niños con DMD bajo un régimen de inmunosupresión, pero con eficacia mínima, aunque esto último estaba ligado al estado avanzado de la enfermedad de los pacientes del ensayo. Actualmente, las investigaciones se centran en usar las propias células del paciente tras haber sido corregidas genéticamente en el laboratorio para producir distrofina convencional, aunque los resultados no estarán disponibles hasta dentro de varios años. En el futuro, se tratarán pacientes más jóvenes (ahora que se conoce que el procedimiento es seguro) de modo que no todas las células satélite estén ya agotadas por la progresión de la enfermedad.
Células inducidas a ser pluripotentes (células iPS)
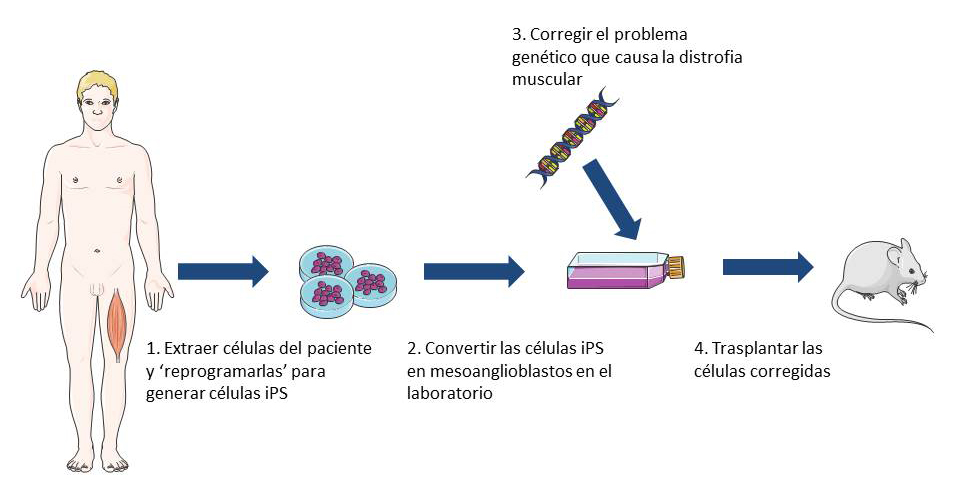
Las células iPS pueden generarse en el laboratorio a partir de virtualmente cualquier célula del cuerpo y son pluripotentes – esto quiere decir que pueden generar cualquier célula del cuerpo. Se ha descubierto recientemente cómo convertir células iPS, originalmente obtenidas a partir de células de la piel de pacientes, en células que se comportan como MAB sanos.
Cuando estas células tipo MAB se inyectaron en ratones con distrofia muscular, los ratones ganaron fuerza muscular, pudieron ejercitarse por más tiempo y produjeron proteínas musculares normales. Este fue un estudio muy preliminar y aún se necesita mucha investigación para establecer si este tipo de tratamiento sería seguro y efectivo en humanos. Sin embargo, estos resultados sugieren que las células tipo MAB obtenidas a partir de células iPS pueden ser una opción viable en el tratamiento de distintos tipos de distrofia muscular. Dado que las células iPS pueden copiarse a sí mismas indefinidamente, se podría obtener teóricamente en el laboratorio una cantidad ilimitada de células tipo MAB a partir de la propia piel del paciente y luego inyectarlas en el torrente sanguíneo. Estas células serían fáciles de cultivar en el laboratorio y tendrían una menor probabilidad de ser rechazadas por el sistema inmune del paciente que las células de donantes.
En la distrofia muscular, las células musculares dañadas y el sistema inmune producen agentes químicos inflamatorios. Estos agentes químicos matan a las células musculares y generan un entorno muscular hostil de tal modo que las nuevas células musculares no pueden crecer ni sobrevivir.
Los científicos piensan que podrían ser capaces de ralentizar la degeneración muscular en pacientes reduciendo la inflamación. Actualmente se utilizan esteroides a tal fin pero se están buscando soluciones alternativas. Estas incluyen:
Tratamientos con medicamentos
Los investigadores están desarrollando medicamentos antiinflamatorios o promotores del crecimiento muscular alternativos para tratar la distrofia muscular. Muchos ensayos clínicos con un gran número de moléculas están en desarrollo pero todavía no contamos con resultados. Algunas nuevas moléculas como PTC124 (que funciona reparando el defecto genético) han obtenido autorización para su uso en el mercado europeo, pero los resultados siguen siendo no concluyentes. Algo parecido pasa con las moléculas pequeñas (oligonucleótidos) que provocan que la maquinaria celular ignore la mutación que previene la síntesis de la distrofina (por un proceso llamado “salto del exón”).
Actualmente no hay terapias basadas en células madre para la distrofia muscular. Las investigaciones han creado algunas rutas interesantes que podrían ser potencialmente efectivas en tratamientos futuros pero todavía se necesita mucho trabajo para determinar si estos tratamientos son seguros y efectivos en humanos. Los principales desafíos que los científicos aún necesitan abordar son:
- Prevenir el rechazo inmune de las células trasplantadas
- Inyectar las células en el torrente sanguíneo para que se distribuyan a todos los músculos
- Superar la baja integración de las células trasplantadas. Por ejemplo, en trasplantes de médula ósea se eliminan las células enfermas. En la DMD, no se pueden eliminar los músculos dañados por lo que a las células trasplantadas les “falta espacio” para integrarse.
Esta hoja informativa fue creada por Rachel Gill.
Editada por Jan Barfoot.
Revisada en 2013, 2016 y 2018 por Giulio Cossu.
El texto traducido fue revisado en 2018 por Asier Galarza Torre.
La imagen principal de la estructura muscular y el diagrama ilustrando el uso de células iPS en la investigación de terapia celular para la distrofia muscular fue producida por Emma Kemp usando Servier Medical Art.
La imagen del músculo de un paciente con distrofia muscular de Duchenne es del Dr. Edwin P. Ewing, Jr y una cortesía del Public Health Image Library del US Department of Health and Human Services.
La fotografía de la fibra muscular es de Mike Kayser, Wellcome Images.
Fibras musculares obtenidas a partir de mesoangioblastos cortesía de OptiStem y creada por Giulio Cossu.